大鼠性激素水平在邻苯二甲酸酯类化合物作用下的变化
- 来源:今日健康
- 关键字:邻苯二甲酸酯,大鼠,性激素
- 发布时间:2015-08-17 13:01
【摘要】目的:通过动物实验,研究不同剂量及不同疗程的DEHP处理后各大鼠性激素水平的改变,探讨其对大鼠卵巢功能的影响。方法:选取SD雌性大鼠80只,随机分为以下8组(每组10只):短疗程空白对照、低、中、高剂量组及长疗程空白对照、低、中、高剂量组。低、中、高剂量组根据体重,分别灌喂DEHP:1000mg/(kg·d),2000mg/(kg·d)和3000mg/(kg·d)。空白对照组:无药物干预。短疗程灌胃14天,长疗程灌胃28天。整个观察期间,每周一、四测量大鼠体重以观察动物生长情况并调整用药剂量。观察期末,各组大鼠选用下腔静脉采血,按酶联免疫试剂盒说明书测血清中孕酮、雌二醇、睾酮、卵泡刺激素、黄体生成素含量。结果:短疗程高、中、低剂量组和空白对照组四组的睾酮水平逐渐下降(P<0.05),具有剂量依赖性;长疗程高、中、低剂量组和空白对照组四组的睾酮水平逐渐下降(P<0.05),具有剂量依赖性;各剂量组的长、短疗程之间的睾酮水平差异均无统计学意义(P>0.05),不具有时间依赖性。与对照组相比,给药组的血清雌二醇、孕酮、卵泡刺激素及黄体生成素水平均无显著性差异(P>0.05),各剂量组的长、短疗程之间的雌二醇、孕酮、卵泡刺激素及黄体生成素水平均无统计学意义(P>0.05)。结论:DEHP引起大鼠血清睾酮水平上升,抑制排卵,具有生殖毒性作用,并具有剂量依赖性,但不具有明显的时间依赖性;推测DEHP对大鼠卵巢功能的影响可能是通过干扰卵巢内分泌调节功能。
【关键词】邻苯二甲酸酯 邻苯二甲酸二乙基己酯 大鼠 性激素
邻苯二甲酸酯类(Phthalate Acid Esters,PAEs)化合物是全球产量较大、应用面较广的人工合成有机化合物之一,而邻苯二甲酸二乙基己酯(Di-(2-ethylhexyl) Phthalate,DEHP)是PAEs中一种重要的化合物。该类化合物与我们日常生活密切相关,可通过饮水、进食、皮肤接触和呼吸等途径进入人体。近年来,随着塑料制品广泛普及,全球PAEs使用量约为180亿吨/年[1],已成为全球最普遍的污染物之一,美国毒物和疾病登记署(ATSDR)检测发现,普通人群每天DEHP最大暴露量可达2mg/kg[2],某些职业接触者会更高。几十年的大量动物实验及体外实验研究发现邻苯二甲酸酯类化合物具有生殖毒性[3] [4] [5]。然而,在PAEs的生殖内分泌毒性研究中,主要是对雄性生殖毒作用的研究,而对女性生殖毒性的作用仍未十分明确。与此同时,近年来临床上发现女性生殖内分泌紊乱性疾病发生率不断升高[6],是否与此化合物污染有关值得关注。本课题从动物实验方面研究大鼠性激素水平在DEHP作用下的变化,以初步探讨DEHP的女性生殖内分泌毒性作用,为临床上研究生殖内分泌紊乱性疾病(如多囊卵巢综合征)的病因提供科学依据。
1 实验材料与方法
1.1 材料
1.1.1 实验动物
雌性白色SD大鼠(Sprague Dawley Rat)80只(由中山大学实验动物中心提供),6-7周龄,体重:170±15g,为SPF动物(无特定病原体动物)。
1.1.2 实验试剂与仪器
邻苯二甲酸二乙基己基酯(DEHP)(化学纯,药品批号:T20090220,由中国科学院广州分院提供),性激素酶联免疫试剂盒购自尚柏生物医学技术(北京)有限公司。
1.2 方法
1.2.1 实验分组与处理
大鼠于屏障环境饲养,层流通风,室温22℃~26℃,昼夜照明,明暗交替时间10/14小时,自由摄食饮水。给药方式和实验分组如下:短疗程低剂量组:DEHP灌胃1000mg/(kg·d)×14天;短疗程中剂量组:DEHP灌胃2000mg/(kg·d)×14天;短疗程高剂量组:DEHP灌胃3000mg/(kg·d)×14天;短疗程空白对照组:无药物干预观察×14天;长疗程低剂量组:DEHP灌胃1000mg/(kg·d)×28天;长疗程中剂量组:DEHP灌胃2000mg/(kg·d)×28天;长疗程高剂量组:DEHP灌胃3000mg/(kg·d)×28天;长疗程空白对照组:无药物干预观察×28天。
1.2.2 根据体重变化调整用药剂量
观察大鼠体重变化动态调整给药量,即每周一、四于清晨8点电子秤称量各组大鼠体重,根据体重变化,调整DEHP灌药剂量,体重精确到克,用1毫升注射器灌药,药液体积精确到0.01毫升。
1.2.3 标本采集与制备
取材:研究结束24小时内,各组大鼠行下腔静脉采血,用3000r/min离心机离心20min,收集血清样品,-20℃储存。术毕用颈椎脱臼法处死动物。
1.2.4 酶联免疫试剂盒检测大鼠血清性激素水平
按照酶联免疫试剂盒说明书操作,测出各浓度标准品的OD值,以OD值为纵坐标,以标准品浓度为横坐标,绘制标准曲线。根据血清样品的OD值在标准曲线上查出其浓度。
1.3 统计学分析
实验结果以x±s表示,采用SPSS13.0统计软件进行统计分析,P<0.05为差异有统计学意义。统计方法用单因素方差分析、Kruskal-Wallis检验、LSD-t检验、Bonferroni检验和秩和检验。
2 结果
将各组大鼠所测的血清性激素水平整理进行分析和比较(见表2-4):
表2-4 各组大鼠卵巢血清性激素水平变化情况(x±s,n=10)
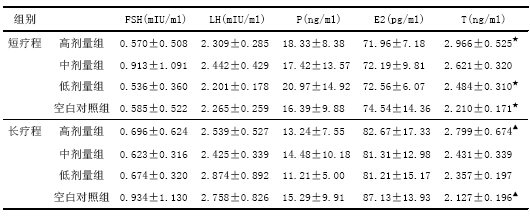
注:★表示短疗程低剂量组、空白对照组与高剂量组相比差异有统计学意义。
▲表示长疗程高剂量组与空白对照组相比差异有统计学意义。
短疗程高、中、低剂量组、空白对照组四组之间的睾酮水平逐渐下降,差异有统计学意义(P<0.05),表明在灌胃刺激和阴道涂片刺激完全相同的情况下,随着剂量的增加,血清的睾酮水平逐渐上升,具有剂量依赖性;长疗程高、中、低剂量组、空白对照组四组之间的睾酮水平逐渐下降,差异有统计学意义(P<0.05),表明在灌胃刺激和阴道涂片刺激完全相同的情况下,随着剂量的增加,血清的睾酮水平逐渐上升,具有剂量依赖性。各剂量组的长、短疗程之间的睾酮水平差异均无统计学意义,即DEHP对血清睾酮的影响不具有时间依赖性。
长、短疗程高、中、低剂量组的E2水平分别比空白对照组稍低,但差异无统计学意义,各剂量组的长、短疗程之间的E2水平差异均无统计学意义;长、短疗程各组间的P、FSH及LH水平均无显著性差异,各剂量组的长、短疗程之间的P、FSH及LH水平均无统计学意义。由于各组大鼠处死时处于不同的动情周期,而E2、P、FSH及LH跟取血时大鼠所处的动情周期的阶段关系密切,波动幅度较大,某些指标还具有排卵前峰值,故其测得的血清水平参考价值受限。
3 讨论
从20世纪80年代开始,人们逐渐发现多种野生动物的生殖系统发育异常。经大量的研究证实环境中某些化学物质能通过与激素受体结合等方式,干扰生物体正常的内分泌功能,是许多野生动物生殖发育异常的重要原因[7],并将这类化学物质称为环境内分泌干扰物[8]。
PAEs化合物是一种重要的环境内分泌干扰物,已成为全球性的环境污染物。DEHP是最重要的PAEs化合物之一,其对人类健康的危害在PAEs化合物中具有普遍的代表意义,且其应用最广泛,污染最严重。已有大量关于男性生殖毒性方面的研究。而近年来女性生殖内分泌紊乱性疾病越来越普遍,例如多囊综合征发病率不断升高,原因不明,是否与环境中不断增加的内分泌干扰物有关尚无明确定论。本研究选用DEHP为研究对象,通过动物实验,研究不同剂量及不同疗程的DEHP处理后各大鼠性激素水平的改变,试图探讨其对大鼠卵巢功能的影响,为临床上研究生殖内分泌紊乱性疾病(如多囊卵巢综合征)的病因提供科学依据。
卵巢具有生殖和内分泌功能,表现为周期性的排卵及分泌相应周期性变化的性激素。正常情况下,一定的雌激素水平与排卵紧密相关,雄激素过多对雌激素产生拮抗作用,对排卵造成一定的影响。本研究发现, DEHP干扰了内分泌功能,大鼠雌二醇水平有所下降,但并不具有统计学意义,与Davis BJ及Lovekamp TN[9]等人的研究结果显示的血清雌二醇水平降低有所差别,但由于雌二醇水平与动情周期各个阶段关系密切,故本研究结果不能排除由于取血时机不同而产生的误差。
Davis BJ及Lovekamp TN[9]等人认为DEHP对卵巢的毒性作用机制是抑制颗粒细胞中芳香化酶的产生,芳香化酶是雄激素向雌激素转化的限速酶,它的减少抑制了雄激素向雌激素的转化,从而在有可能引起雌激素水平下降的同时也使雄激素水平升高,这与本研究结果一致。可以认为大鼠血清睾酮的升高,对雌激素产生拮抗作用,抑制了卵泡成熟及排卵功能。在其它背景因素如灌胃等刺激相同的前提下,大鼠血清睾酮水平随着DEHP剂量的增加而升高,显示出DEHP对大鼠血清睾酮水平的影响具有剂量依赖性,而各剂量组的长短疗程之间的血清睾酮水平没有显著的差别,却没有显示出时间依赖性。从本研究可以推测DEHP对大鼠产生的生殖毒性效应可能是通过干扰卵巢内分泌调节功能,引起内分泌紊乱来实现的,DEHP通过改变大鼠血清睾酮水平而抑制排卵功能,从而影响其正常的生殖功能。此类化合物的污染加重可能是女性内分泌紊乱疾病发生率增高原因之一。
参考文献
[1]Blount BC,Silva MJ,Caudill SP,et al.Levels of seven urinary phthalate metabolites in a human reference population[J].Environ Health Perspect,2000;108 (10):979-982.
[2]Lovekamp ST,Davis BJ.Mechanisms of Phthalate Esters toxicity in the female reproductive system[J].Environ Health Perspect,2003;111(2):139-145.
[3]Zhang YH,Jiang XZ,Chen BH.Reproductive and developmental toxicity in F1 Sprague Dawley male rats exposed to Dinbutyl Phthalate in utero and during lactation and determination of its NOAEL [J].Reprod Toxicol,2004;18:669-676.
[4]Corton JC,Anderson SP,Stauber A.Central role of peroxisome proliferator-activated receptors in the actions of peroxisome proliferators[J].Annu Rev Pharmaeol Toxicol,2000;40:491-518.
[5]Koo HJ,Lee BM.Estimated exposure to phthalates in cosmetics and risk assessment[J].Toxicol Environ Health A,2004;67(23-24):1901-1914.
[6]李卫华,王健,丁训城.新世纪中国环境与生殖健康的状况和展望.[J].世界科学.2002:29-30.
[7]陈学敏.环境卫生学[M].北京:人民卫生出版社.2004:34-35.
[8]Kavlock RJ,Daston GP,Dekosa C,et at.Research needs for the risk assessment of health and environmental effects of endocrine disruptors:a report of the US EPA-sponsored workshop[J].Environ Health Perspect,1996,104(s4):715-740.
[9]Lovekamp TN,Davis BJ.Mono-(2-ethylhexyl) Phthalate suppresses aromatase transcript levels and estradiol production in cultured rat granulosa cells[J].Toxicol Appl Pharmacol,2001;172:217-224.[中山大学附属第六医院妇产科(510655)
王晓红
 关注读览天下微信,
100万篇深度好文,
等你来看……
关注读览天下微信,
100万篇深度好文,
等你来看……












