“绿色反应”在化学教学中的应用——以铜与硝酸反应的改进为例
- 来源:新教育时代·教师版
- 关键字:绿色反应,化学教学,环保
- 发布时间:2015-09-17 15:55
一、问题的提出
化学实验因其简便的操作,魔术般令人印象深刻的现象而深受学生的喜欢。但是化学实验中经常用到或产生有害、有毒的物质,操作不当或者保护措施不到位,就会危害教师和学生的身心健康,大大降低实验带给学生的愉悦感。因此,教师需要对实验精心设计准备,贯彻“绿色环保”理念,力求把污染和危害降到最低。本文以鲁教版高中化学1中铜与稀硝酸的反应为例,来探讨“绿色反应”在化学实验教学中的应用。铜与硝酸的反应是化学教学中较为重要的一个演示实验,教材中演示实验方案为:在2支试管中各放入一小块铜片,分别加入少量的浓HNO3和稀HNO3,立即用浸有NaOH溶液的棉花塞住试管口,观察发生的现象。
在加入浓HNO3的试管中的反应为:
Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
实验现象为:反应剧烈,溶液变绿,有大量红棕色气体产生。此实验的缺点是产生的有毒气体NO2很容易溢散到空气中,造成严重的污染。
含有稀HNO3的试管中的反应则为:
3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O;2NO+O2=2NO2
该反应的现象理论上应该是,反应缓慢,溶液变蓝,有无色气体产生,试管口呈红棕色。但在实际的操作中,也存在许多缺陷:(1)由于试管中的空气没有排除,所以反应开始后就会观察到红棕色气体产生,学生无法观察到无色气体的产生,实验现象与理论无法吻合;(2)反应不易控制,是一种定性反应,反应一旦开始就只好任由反应进行下去,直到反应物铜或稀硝酸消耗完为止,常常教学过程结束了,化学反应仍继续进行着,浪费了实验药品;(3)反应产生的气体不能被蘸有NaOH溶液的棉花完全吸收,装置拆除时气体会污染教室内的空气,对教师和学生身体造成伤害。
不少教师注意到了演示实验的缺陷,提出了不少改进方法或者设计了新的装置[1-3],但是仍然不理想,如装置所用材料虽然价廉,但组装较为复杂、操作不简便、反应不易控制,药品用量大等。因此有必要对该实验进行改进优化,达到操作简便、易于控制、节约药品、“绿色环保”的要求。
二、试验材料及药品
材料:铁架台,烧杯,分液漏斗,橡胶塞,塑料滤网,橡胶管,玻璃导气管,2支10mL注射器。
药品:浓HNO3(16mol/L),稀HNO3(4mol/L),铜片,NaOH溶液(6mol/L)。
三、实验演示
1 实验装置:如图1所示
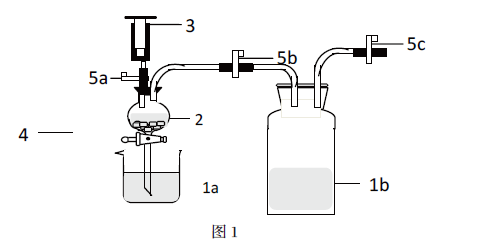
a:HNO3;1b:NaOH;2:分液漏斗;3:注射器;4:铁架台;
5:止水夹
2 实验步骤及现象:
2.1 橡胶塞、玻璃导气管、橡胶管、注射器依次连接,橡胶管加上止水夹。
2.2 将5g铜片放入分液漏斗中(球形颈底部放有塑料滤网),用铁架台固定分液漏斗,分液漏斗的下端插入盛有5mL浓HNO3的烧杯中,橡胶塞塞入分液漏斗的端口中,导气管另一端塞入盛有50mLNaOH溶液的广口瓶中。
2.3 关闭止水夹5b和5c,打开止水夹5a和分液漏斗活塞,用注射器慢慢抽取分液漏斗内的空气,浓HNO3沿着分液漏斗慢慢上升,直到全部抽到漏斗的球形颈中,停止抽拉注射器,立即关闭止水夹5a和分液漏斗活塞,反应剧烈发生,溶液变绿色,有红棕色气体产生;
2.4 反应停止后,打开止水夹5b和5c,取一支注射器插入5c处抽气,将红棕色气体抽入广口瓶中,一段时间以后,看到气体颜色逐渐变浅,最后变为无色。
实验原理是:2NO2+2NaOH=NaNO3+NaNO2+H2O。
2.5 反应终止后,将分液漏斗活塞和止水夹5a打开,溶液回流到烧杯,注射器取少量水冲洗分液漏斗和铜片。将分液漏斗的下端插入盛有20mL稀硝酸的新烧杯中。
2.6 关闭止水夹5b和5c,打开止水夹5a和分液漏斗活塞,用注射器慢慢抽取分液漏斗内的空气,稀硝酸沿着分液漏斗慢慢上升,直到覆盖铜片,停止抽拉注射器,关闭止水夹5a和分液漏斗活塞,铜片逐渐溶解,表面有无色气泡产生,溶液变蓝色;
2.7 反应停止后,打开止水夹5b和5c,取一支注射器插入5c处抽气,可以看到广口瓶中有红棕色气体产生,一段时间以后,看到气体颜色逐渐变浅,最后变为无色。实验原理是:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O;2NO+O2=2NO2;
2NO2+2NaOH=NaNO3+NaNO2+H2O。
四、改进优点
本设计优点非常明显:操作方便、实验现象明显清晰,装置封闭、简约环保。注射器抽取分液漏斗内的空气,同时将稀HNO3缓慢吸进分液漏斗,直到覆盖铜片,停止抽拉注射器,关闭分液漏斗活塞,这样既避免了生成的NO被空气氧化生成红棕色的NO2,也可以很好地控制反应。此外,反应液可以转移,避免污染烧杯中的硝酸,实现实验的相对定量以节约药品,容易实现多次重复操作,适于多班化教学;对反应过程中和反应结束后的有毒气体进行了充分吸收处理,避免了空气污染,体现了“绿色化学”思想,培养了学生的环保意识。
本篇所设计的铜与稀硝酸反应的实验方案,将实验教学与环境保护和“绿色化学”教育巧妙的结合在一起,以现行教材为载体,把绿色教育融入到化学教学中。课堂是教师向学生传递“绿色化学”理念的主阵地,教师要加强对实验的研究和设计,尽可能实现化学反应的“绿色化”,既增强了学生的环保意识,又有助于学生思考问题,增强学生的参与感。
参考文献:
[1]于永民,邹正良,李胜荣.铜与浓、稀硝酸反应实验装置的创新设计[J].化学教育,2015,36(1):65-66.
[2]潘祥泰.NO的制备和性质实验的改进与创新[J].化学教学,2014,(2):44-45.
[3]王玉芬.在注射器中进行铜和硝酸反应实验[J].化学教学,2013,(7):41-42.
刘全
 关注读览天下微信,
100万篇深度好文,
等你来看……
关注读览天下微信,
100万篇深度好文,
等你来看……












